Pirmąjį pasaulyje galvaninį elementą sukūrė Luigi Galvani. Skaitykite apie jo istoriją. šiame straipsnyjeIš esmės tai laikinas elektros srovės šaltinis, susidarantis cheminės reakcijos metu. Elektronų srautas susidaro sąveikaujant dviem skirtingiems metalams. Dėl to cheminė energija paverčiama elektros energija, kurią vėliau galima naudoti kasdieniame gyvenime.
Koncentracijos galvaninis elementas yra srovės šaltinis, kurį sudaro du identiški metaliniai elektrodai, dedami į šio metalo druskų mišinį su skirtingomis koncentracijomis.
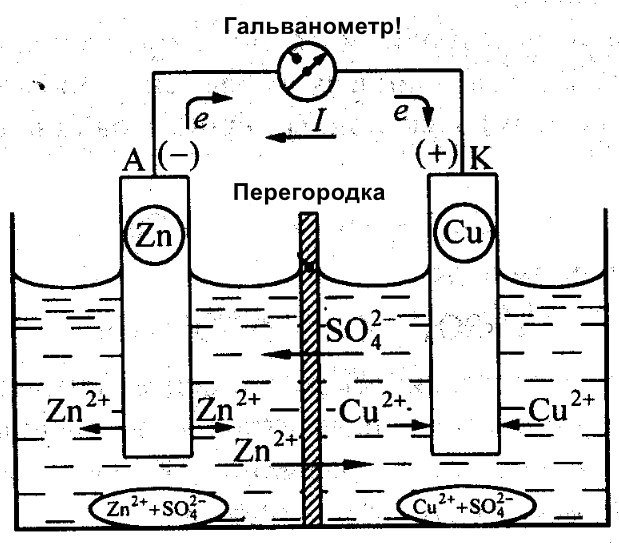
Be Galvani, Danielis Jacobi taip pat dirbo kurdamas efektyvią bateriją. Jis šiek tiek modifikavo savo energijos šaltinį. Jį sudaro vario plokštė, įdėta į CuSO4, ir cinko plokštė, panardinta į ZnSO4. Kad jos tiesiogiai nesąveikautų, tarp jų yra porėta sienelė. Žemiau pateikta Danielio Jacobi galvaninio elemento schema.
Cinkas ir varis pasižymi skirtingu reaktyvumu, todėl jų krūvis skirsis. Dėl to elektrodų lygiai taip pat nėra vienodi. Tai leidžia jiems judėti ir generuoti elektros arba galvaninę srovę. Ši srovė pradeda tekėti, kai žmogus arba srovės kaupimo įrenginio išradėjas prijungia apkrovą. Ši apkrova gali būti lemputė, radijo imtuvas, kompiuterio pelė arba kiti elektros prietaisai.
Galvaninio elemento schema
Grandinės schema nurodo jos sudėtį ir struktūrą. Ją galima sukonstruoti iš kelių cheminių elementų, naudojant pagalbinius įtaisus. Žemiau trumpai aprašoma galvaninio elemento struktūra. Daugiau apie tai skaitykite šiame straipsnyje.!
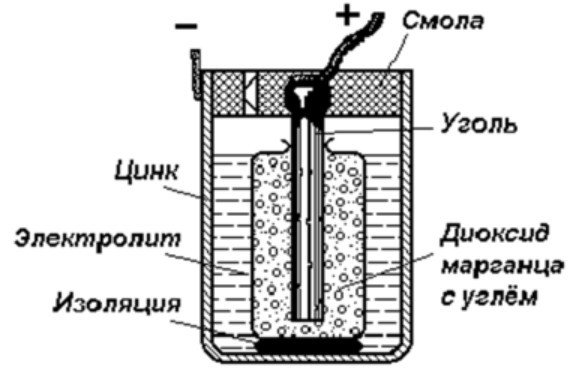
Galvaninio elemento struktūra
Paprasčiausią energijos kaupimo įrenginį sudaro:
- Anglies strypas.
- Du skirtingi metalai.
- Elektrolitas.
- Derva arba plastikas.
- Izoliatorius.
Kaip matyti iš šios diagramos, galvaninį elementą sudaro neigiamas ir teigiamas elektrodai. Jie gali būti pagaminti iš vario, cinko arba kitų metalų. Jie vadinami vario-cinko elementais. Kartais jie vadinami sausos baterijos.
Galvaninio elemento žymėjimas diagramoje Jis sudarytas iš dviejų vertikalių linijų, esančių arti viena kitos nedideliu atstumu. Viena iš jų bus mažesnė. Kiekvienos tokios linijos kraštuose yra ženklai, nurodantys poliškumasIlgoji linija pažymėta teigiamu poliumi, o trumpoji – neigiamu. Įtampa gali būti rodoma šalia jos. Tai reiškia, kad grandinė, naudojanti bateriją, veikia tik esant šiai įtampai.
Galvaninio elemento veikimo principas
Galvaninis elementas veikia elektronams judant iš vieno metalo kontakto į kitą. Vyksta cheminė transformacija. Skaitykite daugiau apie galvaninio elemento termodinamiką ir galvaninės elektros susidarymą. Čia.
Atsakymai į dažnai užduodamus klausimus
| Galvaninis | Paaiškinimas |
| Baterija | Energijos šaltinis, veikiantis per procesus, vykstančius uždaroje, miniatiūrinėje erdvėje. Tiksliau, energija generuojama cheminės reakcijos metu. |
| Volta elementas arba Volta krūva | Tai energijos elementas, kurį pirmą kartą sukūrė mokslininkas, vardu Voltas. |
| Procesas | Cheminių elementų sąveika, dėl kurios susidaro elektros srovė. |
| Išleidimas | Tai yra cheminės reakcijos užbaigimas. Tai yra, tarp medžiagų nebus jokios sąveikos. Galvaninis iškrovimas yra „Warframe“. Iš esmės tai modifikacija, kurios trūksta. Ji naudojama artimojo kovos ginklams. PoliškumasV2. |
| Galvaninis kontaktas | Tai yra kontaktas tarp elektrodų ir tirpalo. |
| Poveikis | Dviejų kontaktų, pagamintų iš dviejų rūšių metalų, skirtumo atsiradimas. Skirtumo dydis priklauso nuo laidininkų temperatūros ir cheminės sudėties. Iš esmės tai yra pirmasis Voltos dėsnis. |
| Jungtis / grandis / grandinė | Dviejų ar daugiau elektros grandinės sekcijų prijungimas prie srovės šaltinio. |
| Galvaninis krūvis | Baterijos pildymas energija. |
Cinkavimas yra cheminis procesas, kurio metu naudojama elektros srovė. Reakcijos metu ištirpusių metalo katijonų kiekis sumažėja tiek, kad jie galiausiai sudaro vienodą dangą ant metalinio elektrodo. Dėl to gaminys tampa patvaresnis, išnyksta nedideli įlenkimai, o jo išvaizda tampa patrauklesnė.
Galvaninių elementų tipai
Yra keletas specifinių baterijų tipų.
Galvaninių elementų lentelė
| Tipas | Įtampa | Pagrindiniai privalumai |
| Litis | 3 V | Didelis talpa, didelė srovė. |
| Druskos baterijos arba anglies-cinko | 1,5 colio | Pigiausias. |
| Nikelio oksihidroksilo NiOOH | 1,6 volto | Didelė srovė. Didelė talpa. |
| Šarminis arba šarminis | 1,6 V | Didelė srovė. Geras garsumas. |
Ši tema išsamiau aptariama straipsnyje. baterijų tipai!
Galvaninio elemento paskirtis
Jis skirtas paleisti elektros įrangą. Tai gali būti:
- Žiūrėti.
- Nuotolinio valdymo pultai.
- Žibintuvėliai.
- Medicininė įranga.
- Nešiojamieji kompiuteriai.
- Žaislai.
- Raktų pakabukai.
- Telefonai.
- Lazeriniai rodyklės.
- Skaičiuoklės.
Ir panašūs dalykai aplink mus.
Galvaninė celė namuose
Paprastą maitinimo šaltinį galite pasigaminti patys. Tam jums reikės šių priemonių:
- Plastikinis puodelis.
- Elektrolitas. Tai gali būti druskos tirpalas, soda arba citrinos rūgštis, praskiesta vandeniu.
- Dviejų skirtingų metalų plokštės. Pavyzdžiui, aliuminis ir varis.
- Laidai
Gamybos procesas
Paimkite plastikinį puodelį ir supilkite į jį elektrolitą. Nepripildykite iki kraštų; geriausia palikti 1–2 centimetrų trumpesnį tarpą. Pritvirtinkite laidus prie metalinių plokštelių. Tada ant indo kraštų uždėkite vario ir aliuminio plokšteles. Jos turėtų būti lygiagrečios viena kitai. Kai viskas bus paruošta, įtampą galite išmatuoti voltmetru.
Prijunkite įrenginį ir palieskite zondus prie mūsų maitinimo šaltinio kontaktų. Laikykite juos vietoje, kol ekrane pasirodys įtampa. Paprastai ji yra 0,5–0,7 volto. Šios vertės priklauso nuo elektrolito arba, tiksliau, medžiagos, naudojamos kaip elektrolitas.
Taip gaminamas naminis galvaninis elementas.